2. 国家蔬菜工程技术研究中心, 北京, 100097
 作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2013 年, 第 11 卷, 第 3 篇 doi: 10.5376/mpb.cn.2013.11.0003
收稿日期: 2012年11月30日 接受日期: 2012年12月17日 发表日期: 2013年04月16日
引用格式(中文):
刘景安等, 2013, 富含多糖的野生西瓜果实RNA提取方法研究, 分子植物育种(online), 11(3): 1014-1018 (doi: 10.5376/mpb.cn.2013.11.0003)
引用格式(英文):
Liu et al., 2013, Study on the Methods of Total RNA Extraction from Wild Type Watermelon Fruit with Rich Polysaccharides, Fenzi Zhiwu Yuzhong (online) (Molecular Plant Breeding), 11(3): 1014-1018 (doi: 10.5376/mpb.cn.2013.11.0003)
野生西瓜果实富含多糖类物质,果实组织高质量RNA提取困难。为解决这一问题,我们把SDS法、改良CTAB法和改良LiCl沉淀法等三种常规RNA提取方法与本研究提出的改良SDS法对野生西瓜PI296341-FR (Citrullus lanatus subsp. Lanatus)果肉RNA提取效果进行了比较和分析。结果表明只有改良SDS法能够在保证RNA质量和产率的同时有效去除多糖。与常规SDS法相比,改良SDS法增加了醋酸钾缓冲液(5 mol, pH 6.0)和无水乙醇(1/4体积)共同沉淀多糖的步骤,但醋酸钾缓冲液用量仅需1/100体积。改良SDS法提取的总RNA完整性、纯度和产率较为理想,28S rRNA和18S rRNA条带清晰,无降解;OD260nm/OD280nm比值为1.97,OD260nm/OD230nm比值为1.91;RNA提取产率为15~20 μg/g•FW,可满足后续分子生物学实验的要求。
野生西瓜材料PI296341-FR属于葫芦科(Cucurbitaceae)西瓜属的野生种(Citrullus lanatus subsp. lanatus),起源于非洲南部。PI296341-FR是目前世界上唯一高抗西瓜枯萎病3个生理小种的种质,是西瓜抗病机制研究和抗病育种的理想材料(许勇等, 2000)。此外,PI296341-FR果实糖含量极低(~1 Brix),与普通栽培西瓜(Citrullus lanatus subsp. vulgaris)果实含糖量(~11 Brix)存在巨大差异,因此也是研究西瓜果实糖代谢和积累机理的理想材料。栽培西瓜果实RNA提取一般采取SDS水饱和酚法(Guo et al., 2011),该法能很好的去除果实中的糖分和蛋白,得到完整性好和条带清晰的总RNA,其28S和18S比接近2:1,能满足后续分子生物学实验的要求。然而,PI296341-FR果实富含有果胶、纤维素等多糖物质,采用该提取方法提取PI296341-FR果实总RNA时,不仅提取出的RNA量很少,而且提取出的总RNA完全降解,无法用于后续分子生物学实验。寻找一种能有效地提取野生西瓜果实总RNA的方法是开展后续分子生物学研究的必要前提,但目前未见相关报道。
PI296341-FR果实总RNA提取的关键是如何有效去除果胶及纤维素等多糖物质的干扰。目前植物RNA提取方法中去除多糖干扰的手段主要有以下三种。第一种,采用SDS-盐酸胍方法在高浓度Na+或K+离子环境中改变多糖的溶解特性,使多糖类物质能够主要分配到有机相中,随后通过苯酚和氯仿抽提去掉大部分的多糖(Su and Gibor, 1988)。第二种,多糖或RNA的选择性沉淀。利用低浓度乙醇(10%~30%)将多糖沉淀,随后RNA经过苯酚和氯仿抽提后用75%乙醇沉淀(肖洁凝等, 2003);利用醋酸钾溶液选择性沉淀多糖(Bahloul and Burkard, 1993; Ainsworth, 1994; Hughes and Galau, 1988);低浓度乙醇和醋酸钾溶液共同作用沉淀多糖(Fang et al., 1992);此外,在高浓度的NaCl下,经低浓度乙醇或2-丁氧乙醇来沉淀多糖(Chang et al., 1993; Manning, 1991; Fang et al., 1992)。但上述方法虽然能去除部分多糖,但效果并不十分理想,提取出的RNA仍混杂有相当多的多糖(Ainsworth, 1994)。第三种,用改良的CTAB法提取富含多糖组织的RNA(李映志等, 2009)也可有效去除多糖的干扰。前人的研究的报道为富含多糖的野生西瓜果实RNA提取方法的探索提供了有益参考。
本研究以富含多糖的野生西瓜PI296341-FR果实为材料,对三种已报道的富含多糖植物组织RNA提取方法进行了筛选、比较和改良,以期摸索出适合于富含多糖的野生西瓜果实的高质量RNA提取方法,为顺利开展相关分子生物学研究奠定基础。
1结果与分析
1.1已报道的三种去除多糖的方法提取野生西瓜果实RNA的效果
根据野生西瓜果实富含多糖的特点,本实验选取了三种已报道的能有效去除多糖的RNA提取方法(改良CTAB法,改良LiCl法,SDS法进行筛选。琼脂糖凝胶电泳检测结果表明三种方法均未能成功提取出野生西瓜果实完整果实总RNA(图1)表明这三种方法均不适合于用作野生西瓜果实RNA的提取。
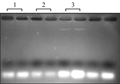 图1 三种方法提取野生西瓜果实总RNA的效果
Figure 1 the efforts of three methods for wild type watermelon fruit total RNA extraction
|
1.2 SDS法的改良
本实验室栽培西瓜果实RNA提取均采用SDS水饱和酚法(Guo et al., 2011),因此本研究的重点是对该方法进行改良,改良的思路重点参考李映志等(2009)报道的方法。改良的重点主要是在PCI(酚:氯仿:异戊醇比例为25:24:1)抽提前加入5 mol/L醋酸钾缓冲液(pH 6.0)和无水乙醇以去除多糖干扰。鉴于参考该方法的提取效果并不理想(方法Ⅳ),本研究同时参考其他成功去除多糖的研究报道(López-Gómez and Gómez-Lim, 1992)对于加入乙醇和醋酸钾缓冲液的量做了多次尝试,选取了6个具有代表性的方法(表1)。通过琼脂糖凝胶电泳检测可知(图2):醋酸钾缓冲液的加入量是影响提取效果的关键;在合适的醋酸钾缓冲液的加入量的前提下,加入1/4体积无水乙醇的提取效果要比加入1/10体积的效果要好(方法Ⅴ和Ⅵ)。
 图2 SDS法提取野生西瓜果实RNA的改良措施
Figure 2 the modified measures of SDS for RNA extraction of wild type watermelon fruit
|
1.3改良的SDS水饱和酚法提取总RNA效果的质量检测及产率
由图2可看出,方法Ⅴ即加入1/100体积的醋酸钾和1/4体积的无水乙醇是提取富含多糖的野生西瓜果实RNA的较好方法。琼脂糖凝胶电泳的检测结果表明该方法提取RNA完整性较好,电泳条带清晰(图2)。该方法提取总RNA的OD260/OD280值是1.97,OD260nm/OD230nm比值为1.91。提取总RNA的产率为15~20 μg•g-1•FW-1。
2讨论
很多植物的果实富含多糖,由于RNA许多理化性质与多糖相似,因此沉淀RNA时会同时将多糖沉淀。这就要求在RNA提取过程中首先应去除多糖的干扰,但去除多糖的同时RNA也会被去掉,造成产量的减少(李宏和王新力, 1999)。同时在沉淀RNA时,多糖会以凝胶状形式共沉淀,这种含有多糖的RNA沉淀难溶于水,或溶解后产生黏稠状的溶液,严重影响了RNA的纯度及后续的分子生物学实验(Fang et al., 1992)。因此对于富含多糖的组织,RNA提取过程中一个关键的问题是如何有效的去除多糖,这也是本研究所要解决的一个关键问题。野生西瓜与栽培西瓜相比虽然水溶性糖含量少很多,但多糖类物质含量如果胶却比栽培西瓜多很多。SDS水饱和酚法能有效的提取出栽培西瓜果实总RNA,但却不适用于野生西瓜PI296341-FR。利用该方法提取野生西瓜果实时,虽然经PCI抽提液抽提后也能将水相、蛋白及有机相分开,但是在下一步吸取水相液体时会因为水相非常黏稠而无法正常吸取,强行吸取会带入大量的中间层蛋白及下层有机相,导致RNA提取失败。这种黏稠现象直观的表明野生西瓜富含有大量的多糖类物质。
目前关于RNA提取过程中去除多糖的报道已有不少。菠萝果实富含多糖类物质,给RNA的提取带来了不便,袁晓丽等(2011)通过对改良SDS法、改良CTAB法和Trizol试剂盒法提取RNA的效果的比较,得出改良SDS法的效果最佳。该方法的一个关键步骤是加入1/3体积5 mol/L KAc溶液(pH 4.8)选择性沉淀多糖,本研究也曾做过类似尝试,但提出的总RNA完全降解,其电泳图类似于图1,表明该方法不适合本研究。栾福磊等(2009)人采取加入低浓度乙醇(10%~15%)来去除多糖,明显降低提取总RNA中多糖的含量。也有报道认为单纯低浓度的乙醇并不能很好的沉淀多糖,还需要与其他试剂相结合才可有效去除多糖(陈桂信等, 2004),本研究结果也支持这种观点。不少研究认为将醋酸钾和无水乙醇共同使用,其去多糖效果会更明显(杜中军等, 2005)。李映志等(2009)采用改良后的CTAB法成功提取出了菠萝蜜富含多糖组织中的RNA。作者采取的一个关键步骤是采用无水乙醇和醋酸钾预先将果胶多糖沉淀下来,以利于后续RNA提取,虽然这也是本研究需要解决的关键问题,但参考其无水乙醇和醋酸钾的用量并不能提取出完整的野生西瓜果实总RNA(图2Ⅳ),但却为进一步的尝试提供了有益的借鉴。本实验经过多次尝试,最终筛选出一种能成功提取出野生西瓜果实完整总RNA的方法(图2Ⅴ)。该方法明显与前人研究结果相比有一个明显不同,即很少量的醋酸钾缓冲液(约1/100体积)即可有效去除大部分果胶,这个量是李映志等(2009)报道的醋酸钾缓冲液加入体积的十分之一;此外,醋酸钾缓冲液加入量多与或少于1/100体积均不能有效提取出完整的RNA。为什么只需要如此少量的醋酸钾缓冲液就可有效去除多糖?这种情况在前人的研究中尚未报道过类似情况,目前尚不清楚具体原因。
3材料与方法
3.1试验材料
本研究选取野生材料PI296341-FR (Citrullus lanatus subsp. Lanatus)作为实验材料。温室育苗,常规管理。于2011年5月初在北京市农林科学院蔬菜中心延庆农场露地定植。定植约四周后开始人工授粉,做标记。常规西瓜栽培管理,3次生物学重复。
PI296341-FR果实取样方法:于授粉后10、18、26、34、42和50天进行取样。每个时间点,每个生物学重复取整齐一致的果实2~3个。取样方法:每个时间点每个生物学重复取果实中心瓤。混合取样。同时留部分果实中心瓤做预备实验用(筛选RNA提取方法)。样品液氮速冻后-80℃冰箱保存备用。
3.2试剂
进口试剂:Tris,SDS,PVP-40,2-mercaptoethanol (2-巯基乙醇),phenol (水饱和酚) (pH 4.5),DEPC,CTAB;国产试剂:浓盐酸,EDTA-Na•2H2O,氢氧化钠,氯化钠,氯仿,异戊醇,无水醋酸钠,冰乙酸,醋酸钾,氯化钙,无水乙醇,LiCl。
3.3总RNA的提取
3.3.1改良的SDS水饱和酚法
(1)快速称取5~6 g冷冻样品,铝箔包裹投入液氮中。液氮预冷研钵和研棒。将样品快速放入研钵、敲碎、研磨。
(2)取另一个研钵加入15 mL TENS提取缓冲液,把样品粉末转移到TENS中,立即研磨充分混匀。转入50 mL离心管,11 000 g,4℃离心5 min。
(3)将上清液转入另一个离心管。在新离心管中缓慢加入1/4体积的-20℃储存的无水乙醇,之后再加入10~25 μL 5 mol/L pH 5.2的醋酸钾缓冲液。轻轻混匀,冰上静置10 min。11 000 g,4℃离心10 min。
(4)将上清液转入新的50 mL离心管,加入等体积PCI (用前摇匀),手工彻底混匀。11 000 g,4℃离心20 min。
(5)重复上述步骤(4)一次。
(6)小心转移上层水相至新的50 mL离心管,加入0.1倍体积的3mol/L (pH 5.2)醋酸钾缓冲液和2.5倍体积的冰冷无水乙醇(−80℃预冷),−20℃静置1 h。
(7)11 000 g,4℃离心20 min,吸弃所有上清和管壁残留水滴,并在管壁圈出沉淀所在位置。
(8)空气干燥沉淀20~25 min,用600 μL RNase-free水溶解离心管沉淀。转入2 mL离心管。电泳检测RNA完整性,NanoDrop2000检测并记录浓度和质量。-80℃保持备用(注: 栽培西瓜提取步骤不同之处是TENS混匀液直接加PCI, 并且不需要加醋酸钾和无水乙醇, 其余同上面方法)。
3.3.2改良的CTAB法
改良的CTAB法具体操作过程参考李映志等(2009)。
3.3.3改良LiCl法
具体操作方法参考叶庆亮等(2007)。
3.4总RNA的质量检测
RNA纯度分析:取2 μL RNA,用NanoDrop2000检测并记录浓度和质量。根据OD260/OD280,OD260/OD230的值确定RNA的纯度。
取少量RNA (5 μL)与1 μL的6x loading buffer混匀。1.5%琼脂糖凝胶电泳检测(150 V进样, 80~90 V电泳; 约25 min) RNA的完整性。
作者贡献
刘景安是本研究的实验设计和实验研究的执行人,完成论文初稿的写作;郭绍贵和张海英参与论文的修改;宫国义和任毅参与实验设计;许勇是项目的构思者及负责人,指导实验设计,数据分析,论文写作与修改。全体作者都阅读并同意最终的文本。
致谢
本研究由国家自然科学基金(30972015)和北京市自然科学基金重大项目(5100001)共同资助。
参考文献
Ainsworth C., 1994, Isolation of RNA from floral tissue of Rumex Acetosa (sorrel), Plant Mol. Biol. Rep., 12(3): 198-203
http://dx.doi.org/10.1007/BF02668741
Bahloul M., and Burkard G., 1993, An improved method for the isolation of total RNA from spruce tissues, Plant Mol. Biol. Rep., 11(3): 212-215
http://dx.doi.org/10.1007/BF02669847
Chang S., Puryear J., and Cairney J., 1993, A simple and efficient method for isolating RNA from pine trees, Plant Mol. Biol. Rep., 11(2): 113-116
http://dx.doi.org/10.1007/BF02670468
Chen G.X., Lu L.X., Lai Z.X., and Pan D.M., 2004, Extraction and purification of total RNA from young buds of Nai (Prunus salicina Lindl. var. cordata), Jiangxi Nongye Daxue Xuebao (Acta Agricuhurae Universitatis Jiangxiensis), 26(3): 324-328 (陈桂信, 吕柳新, 赖钟雄, 潘东明, 2004, 榇嫩芽总RNA的提取与纯化, 江西农业大学学报, 26(3): 324-328)
Du Z.J., Xu B.Q., Huang J.S., Wang J.B., and Xu L., 2005, An improved method for extracting intact total RNA from Mango tissues rich in polysaccharides, Zhiwu Shenglixue Tongxun (Plant Physiology Communications), 41(2): 202-204 (杜中军, 徐兵强, 黄俊生, 王家保, 徐立, 2005, 一种改进的富含多糖的芒果组织中完整总RNA提取方法, 植物生理学通讯, 41(2): 202-204)
Fang G., Hammar S., and Grumet R., 1992, A quick and inexpensive method for removing polysaccharides from plant genomic DNA, Biotechniques, 13(1): 52-54, 56
PMid:1503775
Hughes D.W., and Galau G., 1988, Preparation of RNA from cotton leaves and pollen, Plant Mol. Biol. Rep., 6(4): 253-257
http://dx.doi.org/10.1007/BF02670385
Guo S.G., Liu J.G., Zheng Y., Huang M.Y., Zhang H.Y., Gong G.Y., He H.J., Ren Y., Zhong S.L., Fei Z.J., and Xu Y., 2011, Characterization of transcriptome dynamics during watermelon fruit development: sequencing, assembly, annotation and gene expression profiles, BMC Genomics, 12(1): 454
http://dx.doi.org/10.1186/1471-2164-12-454 PMid:21936920 PMCid:3197533
Li H., and Wang X.L., 1999, The difficulties in the isolation of RNA from plant tissues and their resolving strategies, Shengwu Jishu Tongbao (Biotechnology Information), (1): 36-39 (李宏, 王新力, 1999, 植物组织RNA提取的难点及对策, 生物技术通报, (1): 36-39)
Li Y.Z., Wu C.H., He C.Y., Li J.Y., and Ye C.H., 2009, Isolation of total RNA from leaf and inflorescence of Jackfruit, Redai Zuowu Xuebao (Chinese Journal of Tropical Crops), 30(2): 167-169 (李映志, 吴成焕, 何楚义, 黎结义, 叶春海, 2009, 用改良CTAB法提取波罗蜜叶和花序总RNA, 热带作物学报, 30(2): 167-169)
Luan F.L., Han Y.S., Shao Y., Lu C.W., Chen A.J., Li L., Tian H.Q., Luo Y.B., and Zhu B.Z., 2009, Effective isolation of high-quality total RNA from polysaccharide or polyphenol-rich fruits, Shiping Kexue (Food Science), 30(13): 29-32 (栾福磊, 韩友生, 邵毅, 卢丞文, 陈安钧, 李玲, 田慧琴, 罗云波, 朱本忠, 2009, 高效提取富含多糖多酚的果实组织中总RNA的方法, 食品科学, 30(13): 29-32)
López-Gómez R., and Gómez-Lim M.A., 1992, A method for extracting intact RNA from fruits rich in polysaccharides using ripemango mesocarp, Hort Science., 27(5): 440-442
Manning K., 1991, Isolation of nucleic acids from plants by differential solvent precipitation, Analytical Biochemistry, 195(1): 45-50
http://dx.doi.org/10.1016/0003-2697(91)90292-2
Su X., and Gibor A., 1988, A method for RNA isolation from marine macro-algae, Analytical Biochemistry, 174(2): 650-657
http://dx.doi.org/10.1016/0003-2697(88)90068-1
Xiao J.N., Huang X.L., Li Y., Huang X., and Li X.J., 2003, RNA extraction from cotyledon of mango with high levels of secondary substances and carbohydrates, Zhongguo Shengwu Gongcheng Zazhi (China Biotechnology), 23(11): 83-86 (肖洁凝, 黄学林, 黎茵, 黄霞, 李莜菊, 2003, 富含多糖和次生物质的芒果子叶总RNA的提取, 中国生物工程杂志, 23(11): 83-86)
Xu Y., Zhang H.Y., Kang G.B., Wang Y.J., and Chen H., 2000, Studies of molecular marker-assisted-sellection for resistance to Fusarium Wilt in watermelon (Citrullus lanatus) breeding, Yichuan Xuebao (Acta Genetica Sinica), 27(2): 151-157 (许勇, 张海英, 康国斌, 王永建, 陈杭, 2000, 西瓜抗枯萎病育种分子标记辅助选择的研究, 遗传学报, 27(2): 151-157)
Ye Q.H., Peng A.H., Cao L., Jiang D., and Zhong G.Y., 2007, An effective and general protocol for the isolation of total RNA from the tissues of Citrus trees, Jiangxi Nongye Daxue Xuebao (Acta Agriculturae Universitatis Jiangxiensis), 29(5): 732-739 (叶庆亮, 彭爱红, 曹立, 江东, 钟广炎, 2007, 柑橘类果树组织总RNA优异且通用的提取方法, 江西农业大学学报, 29(5): 732-735)
Yuan X.L., Wang W., Sun G.M., Du L.Q., and Zhang X.M., 2011, Comparison of three methods for total RNA extraction from different sections of pineapple fruit, Guangdong Nongye Kexue (Guangdong Agricultural Sciences), (10): 132-134 (袁晓丽, 王蔚, 孙光明, 杜丽清, 张秀梅, 2011, 菠萝果实不同部位总RNA提取方法比较, 广东农业科学, (10): 132-134)
